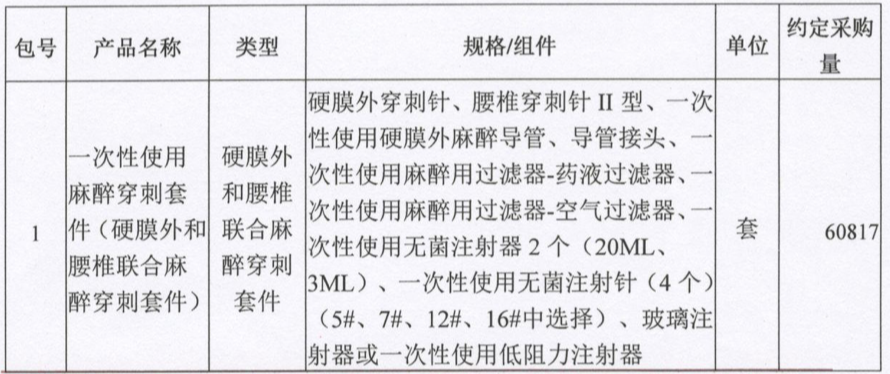
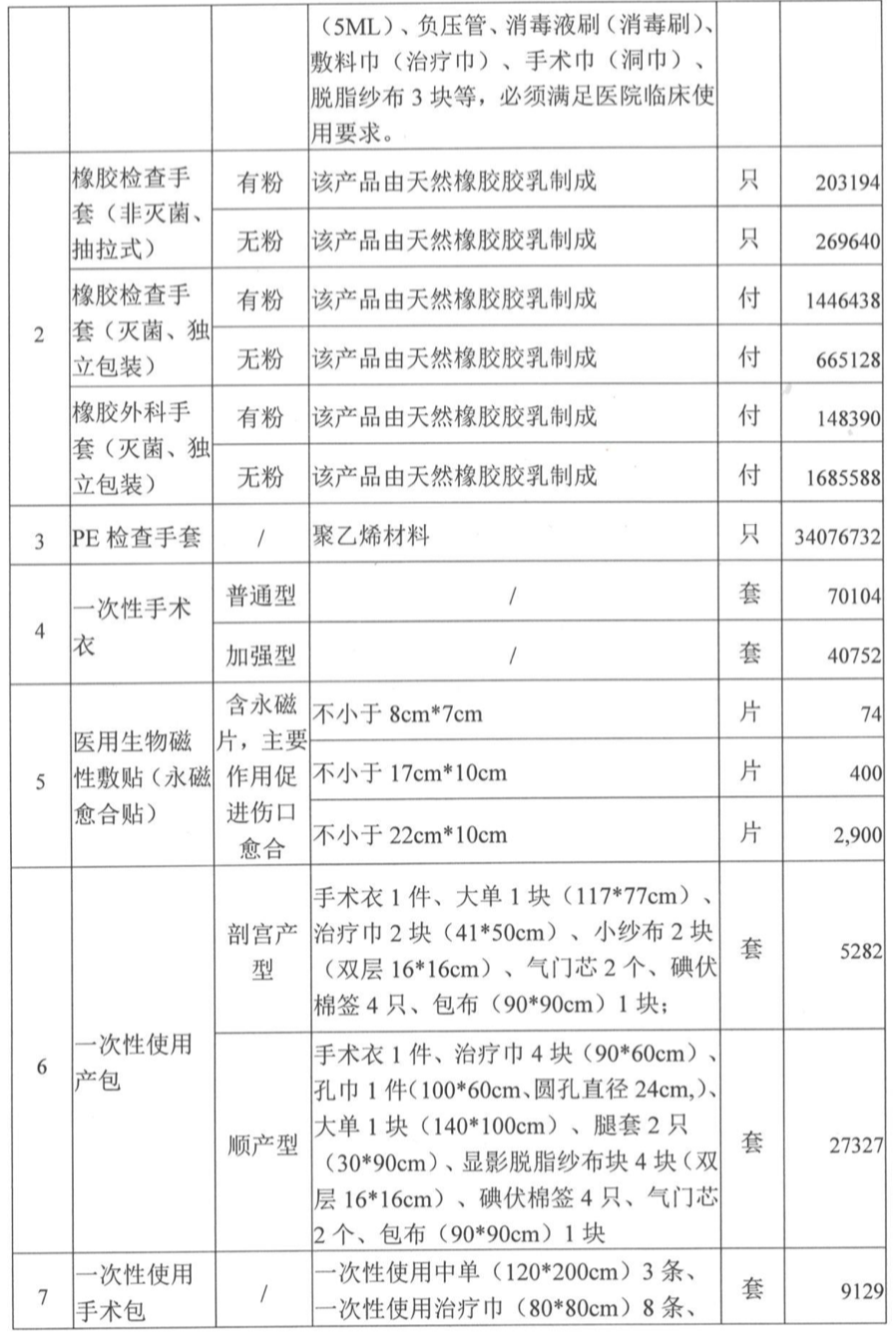
799个医疗器械获批,强生、西门子、飞利浦、东软…
2022年1-4月,共有799个医疗器械产品获批。
4月
近日,国家药监局发布公告,2022年4月,国家药品监督管理局共批准注册医疗器械产品212个。其中,境内第三类医疗器械产品154个,进口第三类医疗器械产品35个,进口第二类医疗器械产品20个,港澳台医疗器械产品3个。
据赛柏蓝器械观察,本次获批产品的企业包含西门子、强生、美敦力、飞利浦、波士顿科学、东软、联影等。
详情如下:
3月
近日,国家药监局发布公告,2022年3月,国家药品监督管理局共批准注册医疗器械产品181个。其中,境内第三类医疗器械产品138个,进口第三类医疗器械产品23个,进口第二类医疗器械产品18个,港澳台医疗器械产品2个。
据赛柏蓝器械观察,本次获批产品的企业包含飞利浦、波科、碧迪、施乐辉、迈瑞、联影、乐普、微创等。
详情如下:
2022年3月批准注册医疗器械产品目录
2月
2022年2月,国家药品监督管理局共批准注册医疗器械产品198个。其中,境内第三类医疗器械产品137个,进口第三类医疗器械产品36个,进口第二类医疗器械产品22个,港澳台医疗器械产品3个。
详情如下:
2022年 2月批准注册医疗器械产品目录
1月
2022年1月,国家药品监督管理局共批准注册医疗器械产品208个。其中,境内第三类医疗器械产品151个,进口第三类医疗器械产品21个,进口第二类医疗器械产品33个,港澳台医疗器械产品3个。
2022年1月批准注册医疗器械产品目录
来源:国家药监局 整理:赛柏蓝器械 …