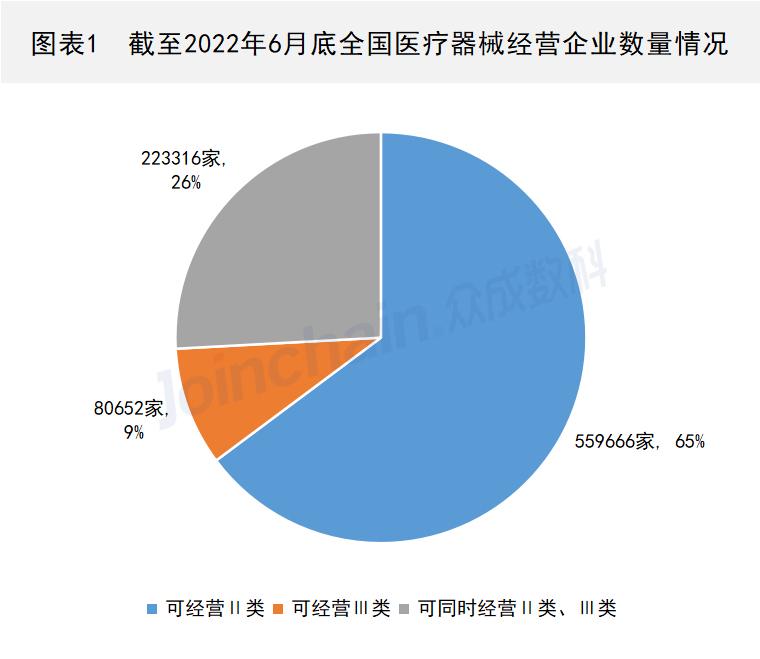
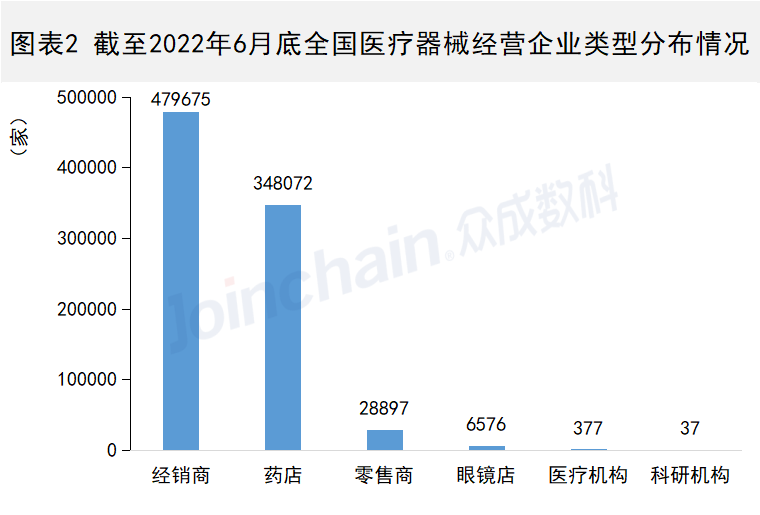
近日,多家新冠检测上市公司发布2022年半年度业绩预告。据不完全统计,2022年上半年,多家新冠检测上市公司凭借新冠抗原检测试剂业务业绩“爆表”,其中,九安医疗净利增超27000%。
有公司净利增超27000%
根据公告,天津九安医疗电子股份有限公司(下称九安医疗)与武汉明德生物科技股份有限公司(下称明德生物)均披露抗原检测业务为公司取得的净利润的大幅增长。
15日,九安医疗披露2022年半年度业绩预告称,预计上半年实现归属于上市公司股东的净利润151亿元至155亿元,同比增长27466.36%至28196.60%;扣除非经常性损益后的净利润151亿元至155亿元,值得注意的是,上年同期亏损478.74万元。
对于业绩变动的原因,九安医疗称,报告期内由于iHealth试剂盒产品在报告期内销售收入大幅增长,公司本报告期业绩较去年同期也出现大幅上升。
九安医疗进一步表示,报告期内受美国疫情发展的影响,当地对新冠抗原检测试剂盒产品需求大幅增长。公司iHealth试剂盒产品获得了美国的FDA EUA授权,并以公司自主品牌“iHealth”通过美国子公司网站及亚马逊美国电商平台进行to C端的销售,同时承接政府订单及商业订单。2021年年报显示,该产品可由个人自行采集前鼻腔拭子样本进行操作,15分钟快速出结果。
15日,明德生物披露2022年半年度业绩预告称,预计实现归属于上市公司股东的净利润24亿元至27.5亿元,同比增长314.11%至374.50%。
不过据推算,明德生物第二季度环比业绩已出现滑坡。15日,便有投资者提问公司第二季度收益下滑的主要原因,明德生物在投资者问答平台上回应称,公司第二季度新冠核酸检测产品较第一季度平均价格有所下降,主要原因是响应国家医保局办公室、国务院应对新冠病毒肺炎疫情联防联控机制医疗救治组等关于进一步降低新冠病毒核酸检测和抗原检测价格的号召。
据其介绍,2022年5月广东联盟集采实施后,明德生物新冠核酸检测试剂和抗原检测试剂中标价格均有所下调。
15日,广州金域医学检验集团股份有限公司(下称金域医学)披露2022年半年度业绩预增公告称,预计实现归属于上市公司股东的净利润15.5亿元到16.8亿元,同比增长46.33%至58.61%。
金域医学表示,本期业绩预增的主要原因是产品结构和客户结构持续优化,公司加强精细化管理,提升运营效率,规模效应逐步显现。
13日,广州达安基因股份有限公司(下称达安基因)披露2022年半年度业绩预告,预计2022年上半年实现归属于上市公司股东的净利润33亿元至37亿元,同期增长106.52%至131.56%。
据了解,达安基因主营业务为体外诊断。达安基因表示,业绩变动的原因是,报告期内达安基因作为国内新冠核酸诊断产品的核心供应商之一,启动充足的产能提供新型冠状病毒核酸检测产品,保障市场供给。同时持续加强海外市场的开拓与布局。市场对新型冠状病毒(2019-nCoV)核酸检测试剂盒及核酸检测仪器、相关耗材的需求持续,对公司业绩产生了积极影响。
12日,疫苗龙头北京万泰生物药业股份有限公司(下称万泰生物)发布业绩预告显示,预计2022年半年度实现归属于母公司所有者的净利润为25亿元到27.5亿元,同比增加246%到281%。
…