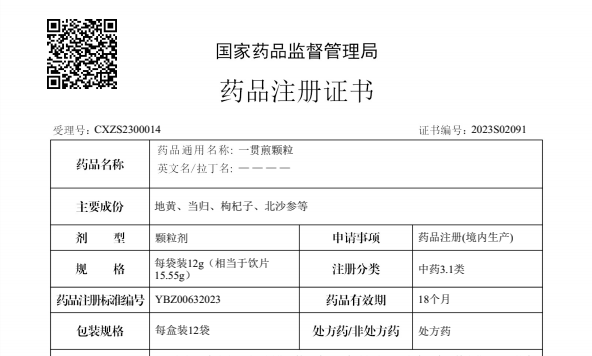
上海GPO983个品种开始议价,5月15日截止
4月25日,上海GPO发出《关于开展2024年药品集中议价采购工作的公告》,该联盟将进行集中议价采购,纳入种药品,其中西药495个、中药488个。
响应企业(符合资质的药品生产企业,或接受委托的本市药品经营企业。)申报的集中议价采购价格,应符合本市阳光平台工作要求,并低于本市医疗机构单独议价价格。正在执行的集中议价中选品种,需进行价格确认。企业进行网上注册和报价,报价截止时间:2024年5月15日17时。
采购周期以联盟医疗机构正式采购之日起,一般 12 个月为一个 周期。对所采购品种需继续延续使用的, 以 6 个月为单位,一般最多延续 2 次。
采购联盟工作组按照综合评价、价格优先的议价工作规则,对申报企业进行集中遴选(西药按成分途径、中成药按功能主治分类),产生中选企业,并最终形成药品集中议价推荐目录(包括中选、保供、不推荐、不建议品种等类别)。
按《上海公立医疗机构(部分)药品集中议价采购联盟 药品集中议价采购(试点)工作规则》,参考采购联盟医疗机构 2023 年实际采购药品总量,按 照“量价挂钩”的市场机制,以及团购与单独采购成本差异,进行集中议价,形成药品集中议价推荐目录。联盟医疗机构优先使用药品集中议价推荐目录内的品种, 自主采购部分需经医院药事会讨论通过。
按照综合评价、价格优先的工作规则对申 报药品评价,综合评价包括药品质量评价、临床专业评价、经济评价等。
声明: 本网站上转载的文章,仅供交流,不为其版权负责。如您发现有侵犯您的知识产权的作品,请与我们联系,我们会及时修改或删除。