安徽:22项服务举措促医药产业发展
4月10日,安徽省药监局推出关于持续深化“一改两为”提升工作效能优化营商环境的若干举措,采取“实施‘药安’品质提升行动、优化审批流程、降低涉企注册收费”等22项措施,助力安徽省医药产业高质量发展。
持续为药企优环境。持续开展“药企政策我来答”“药械创新我来帮”等活动,打造药监窗口“帮办服务”品牌;启动“百名专家助药企”活动,持续开展“百人访千企、纾困解难题”主题活动,积极帮扶药企解决问题。
压缩注册检验环节。将药品注册检验(含方法学复核)的检验周期,由60个工作日压缩至55个工作日,医疗器械生物学评价不超过80个工作日;12月31日前,将药品再注册费、医疗器械产品变更注册费按现行收费标准80%收取,医疗器械产品延续注册费按现行收费标准50%收取。
加强“双招双引”。在优化审批服务的基础上,重点引育生物医药、医学影像设备、体外诊断试剂等领域企业;加快推动我省现有中药饮片及中成药企业规模化、品牌化发展,大力实施“十大皖药”产业示范基地建设提升工程,进一步打响“十大皖药”品牌。(见习记者 罗晓宇)
来源:安徽日报
…
国家药监局批准注册162个医疗器械产品的公告
序号 | 产品名称 | 注册人名称 | 注册证编号 |
境内第三类医疗器械 | |||
1 | 可扫描愈合基台 | 深圳市易植医疗科技有限公司 | 国械注准20233170100 |
2 | 锁定型金属接骨板系统 | 江苏乾瑞医疗器械有限公司 | 国械注准20233130101 |
3 | 非锁定金属接骨螺钉 | 江苏维尔康医疗科技有限公司 | 国械注准20233130102 |
4 | 动脉血气针 | 美欧微科医疗武汉有限公司 | 国械注准20233220103 |
5 | |||
深入推进新冠病毒检测试剂质量安全监管电视电话会议召开
6月9日,国家药监局召开进一步加强新冠病毒检测试剂质量安全监管电视电话会议,总结前一阶段新冠病毒检测试剂质量安全监管工作情况,交流工作经验,深入推进全系统持续开展新冠病毒检测试剂质量安全监管。国家药监局党组成员、副局长徐景和出席会议并讲话。
会议指出,自新冠肺炎疫情暴发以来,全国药监系统认真贯彻党中央、国务院决策部署,全面实施《医疗器械监督管理条例》,坚持人民至上、生命至上,牢记人民健康是“国之大者”,持续加强新冠病毒检测试剂质量安全监管,有力推动了企业主体责任和属地监管责任的落实,有效强化了产品质量安全保障。近日,国家药监局组织开展的2022年第一轮新冠病毒核酸检测试剂全覆盖抽检,检验结果均符合要求。
会议强调,新冠病毒检测试剂产品质量安全状况,直接关系疫情防控大局。全系统要深入贯彻党中央、国务院领导同志指示批示精神,全面落实药品安全专项整治要求,进一步统一思想、深化认识,提高政治站位,对新冠病毒核酸检测试剂实行“最严格的监管”,采取更加坚决有力的措施,慎终如始,再接再厉,持续加强新冠病毒检测试剂质量安全监管。一是持续从严从细抓好产品质量监管。各级药品监管部门要持之以恒抓实抓细各项监管工作,监督注册人严格落实企业主体责任,坚决守住产品质量安全底线。二是持续加强产品研制环节质量监管。各省级药品监管部门要进一步加强对新冠病毒检测试剂研发和注册申报工作的指导,督促注册人认真履行主体责任,确保产品研发过程规范,注册申报资料真实、准确、完整和可追溯。三是持续加强产品生产环节质量监管。各省级药品监管部门要继续组织专业力量对本辖区新冠病毒检测试剂注册人及其受托生产企业开展监督检查,重点关注质量管理体系运行情况,发现生产活动存在严重违规行为,不能保证产品安全有效的,要责令企业立即暂停生产、召回问题产品并进行有效处置。企业违规情节严重的,要依法吊销医疗器械生产许可证,并对相关责任人依法进行处罚。四是持续加强产品经营环节质量监管。市县药品监管部门要进一步做好对新冠病毒检测试剂经营企业的监督检查,监督经营企业严格按照法规、规范要求组织开展经营活动。五是持续加强使用环节产品质量监管。市县药品监管部门要依职责切实加强新冠病毒核酸检测试剂使用环节产品质量安全监管,认真检查医疗机构使用的新冠病毒核酸检测试剂的产品资质、进货渠道、效期管理等是否符合要求、质量是否合格。六是持续加强产品质量监督抽检。对注册人、受托生产企业生产的新冠病毒检测试剂产品,开展全覆盖抽检工作。七是持续严厉打击违法违规行为。对未经许可生产经营、违规贮存运输、经营使用未经注册或者过期的新冠病毒检测试剂等违法违规行为,要依法从严从重从快查处。发现涉及其他部门监管职责的违法违规行为,及时通报相关部门;涉嫌构成犯罪的,要及时移送公安机关;监管人员涉嫌失职渎职的,要及时移送纪检监察机关。
会上,北京市药监局、上海市药监局、陕西省西安市市场监管局以及上海之江生物科技股份有限公司、圣湘生物科技股份有限公司、广州达安基因股份有限公司负责人做交流发言,分别围绕企业落实全生命周期质量管理责任,保证产品质量安全,持续加强研制、生产、经营、使用环节产品质量监管等分享了工作经验和做法。
国家药监局相关司局、直属单位负责同志在主会场参会。各省、自治区、直辖市及新疆生产建设兵团药监局有关负责同志在分会场参会。
来源:国家药品监督管理局网站…
113个!2020年以来应急审评审批医疗器械盘点
2020年1月以来,医疗器械技术审评中心按照“统一指挥、早期介入、随到随审、科学审批”的原则和产品安全、有效、质量可控的要求,截至2022年1月20日,已完成72个新型冠状病毒检测试剂盒、34个仪器设备、4个软件、3个敷料产品的应急审评工作,上述113个产品经国家药监局审批获准上市。
2021年1月至12月,完成30个产品的应急审评工作,包括14个新型冠状病毒检测试剂盒,13个配套仪器设备,3个软件,上述产品均经国家药监局审批获准上市。
检测试剂盒
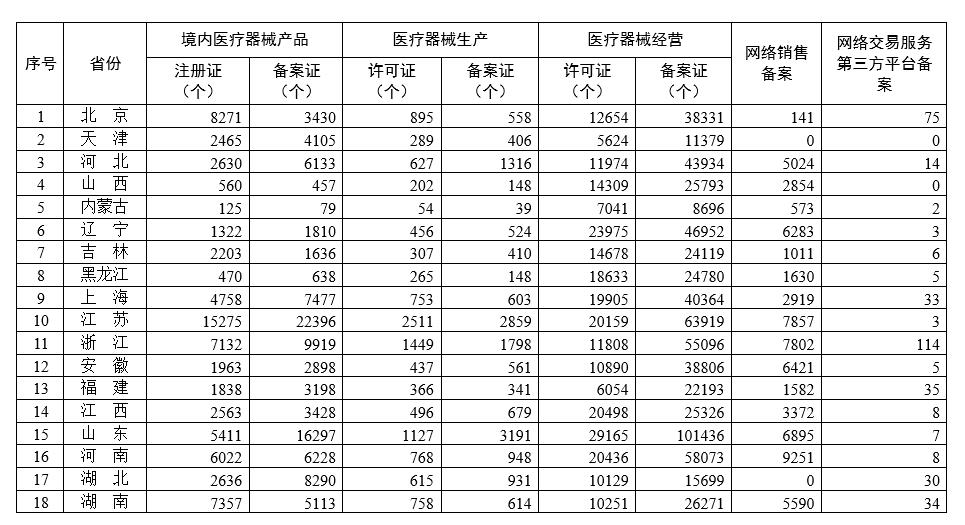
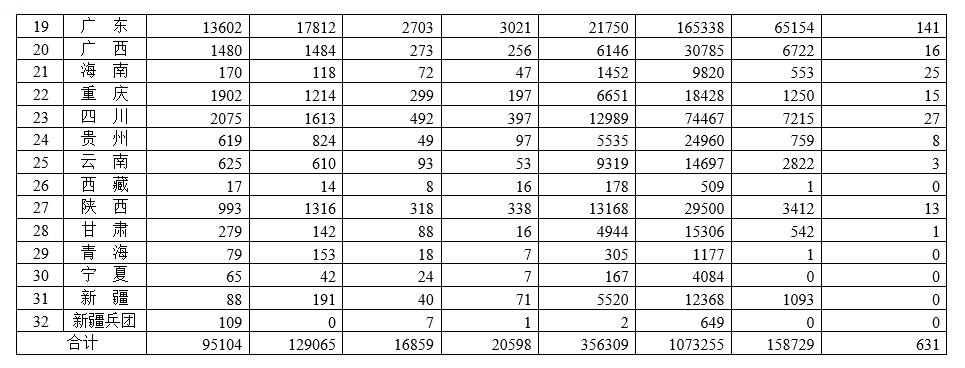
各省医疗器械许可备案相关信息(截至2022年8月31日)
国家药监局:保证医疗器械运贮环节质量安全,推进全程可追溯
旺盛需求亟待满足体外膜肺氧合进口替代正在加速