2023年上半年28个创新医疗器械获批上市,京粤苏浙位列前五!
6月20日,国家药监局批准了睿谱外科系统股份有限公司生产的“头颈部X射线立体定向放射外科治疗系统”创新产品注册申请。至此,国家批准的创新医疗器械已有217个。仅今年上半年,就有28个创新医疗器械获批上市,有力满足了人民群众的健康需要。
据统计,2014年批准1个创新器械,2015年批准9个,2016年批准11个,2017年批准12个,2018年批准21个,2019年批准19个,2020年批准26个,2021年批准35个,2022年批准55个。通过每年审核通过的数据比对,我们可以清晰的发现,我们的审核速度明显加快,从趋势图中显示,每年基本以稳定小迈步上升趋势在增加。
由此可见,我国高度重视医疗器械的创新发展,并对具有发明专利、技术上具有国内首创、国际领先水平、并且具有显著临床应用价值的医疗器械设置了特别审批通道。2022年,高端医疗装备国产化有新突破,国家药监局共批准55个创新医疗器械产品上市,同比增长57.1%。2023年截至目前批准24个。
2014-2023年中国新增上市创新医疗器械数量统计
从地域来看,2023上半年获批产品较多的区域仍然集中在发达地区。北京市获批产品的数量最多,共有6个,其次是广东省4个、浙江省3个、江苏省和上海市均有2个,此次美国、加拿大也均有获批产品,其中美国有5个,仅次于北京市位列第二。
各地区通过审批占比
在这个情况下,可以看出中国正在积极推进医药及医疗器械行业的创新。这可能是通过推行更有利于研发和创新的政策,加快药品和医疗器械的审批进程,以及增加对医药产业科研的投资等方式实现的。进一步的细节和数据将取决于具体的政策,具体的审批速度和数量,以及具体的研发投入。
这些年国家药监局的审批量和受理量的增加,可能意味着更多的新药和新的医疗器械正在等待审批,或已经获得了审批。这可能表明,随着政策的推动和制度的完善,更多的公司和研究机构正在投入药品和医疗器械的研发,从而推动了行业的创新。
总的来说,这是一个非常积极的趋势,可能会对中国的医药产业产生深远影响,进一步改善医疗服务,并对全球健康产业产生积极影响。
2023年医疗器械优先审批申请审核公示结果
18个申请来自国内,1个申请来自美国。18个国内申请中,江浙沪超过半数,其中浙江4个,江苏4个,上海4个,各省申请进入创新医疗器械特别审查的公示结果如下:
2023年创新医疗器械特别审查申请审查公示结果
2014年3月1日,由国家药监局发布的《创新医疗器械特别审批程序》正式施行,并于2018年进行首次修订。针对我国具有发明专利、技术上具有国内首创、国际领先水平,并且具有显著临床应用价值的医疗器械设置特别审批通道。
28个创新医疗器械获批上市的产品及创新点目录
来源:医疗器械创新网…
突破国外封锁!核磁共振仪器成功开始量产
核磁共振仪器被誉为“尖端医疗设备皇冠上的明珠”,对于心脑血管、神经和肿瘤等多种重大疾病影像诊断有重大意义,但这项技术长期被国外封锁。不久前,我国自主研发的核磁共振仪器研制成功,开始量产。
将核磁共振仪器搬上生产线并不是一件容易的事情,这其中不光要解决“卡脖子”的技术难题,还有如何解决科技成果转化的问题。他们是怎么缩短实验室和生产线之间的距离的呢?
记者在中国科学院深圳先进技术研究院看到,生产线上生产的是我国自主研发的核磁共振仪器,画面中白色的圆柱体就是正在生产中的仪器,经过一系列复杂精密的程序之后,它将出现在医院的检查室里。
北京大学深圳医院医学影像科副主任技师 张辉:它的图像质量一点都不逊色于国际先进的核磁共振仪器生产厂家,价格也已经比以前大大地降低了,我们医院的医疗检查费相对于以前也在逐步地降低,这对于我们广大人民群众来说,看病的时候花费就会更少了。
北京大学深圳医院里,这台我国自主研发的核磁共振仪器正在工作。仪器工作的情况,实时传输到15公里外的中国科学院深圳先进技术研究院。
总台记者 朱慧容:在分辨率不是很高的核磁共振机器做出来的情况,看不出来具体的病灶在哪里。但是在这个分辨率很高的核磁共振提供的影像上,就明显地看出,这里可能是一个肿瘤的所在位置。
记者了解到,这款仪器可以获得人体的全身影像,不仅分辨率更高,还加速了成像速度。
中国科学院深圳先进技术研究院医工所副所长 李烨:以前我们核磁共振就像拍照片一样,是一张一张的,你一动照片就糊了。我们现在有了快速成像技术之后,组织动也不怕,我们可以看到它动的过程。
不仅仅是在核磁共振的影像诊断装备上有重大突破,记者了解到,眼下中国科学院深圳先进技术研究院,已经研发出可以为肝脏和乳腺疾病提供早期筛查的无创超声弹性成像技术;研发的为帕金森、癫痫、阿尔茨海默病提供治疗的超声神经调控重大仪器也开始进行临床试验。
产业需要什么
他们就研究什么
从中国科学院深圳先进技术研究院这些正在进行的研究上可以看出来,最前沿的合成生物、脑科学、海洋科技等都是他们的课题,研究院负责人告诉记者,所有这些课题都有一个共同的目标,那就是面向产业需求。
调研中,记者了解到,2022年,中国科学院深圳先进技术研究院各类研究项目经费超过33亿元,其中只有17%是政府拨付的固定经费,83%的经费都需要依靠与产业合作等多种方式获得,这也就是说,科研项目从立项之初,就要和产业需求牢牢绑定。
中国科学院深圳先进技术研究院副院长 郑海荣:它是以重大需求导向,特别是以产业的核心技术需求导向,产业里的“卡脖子”问题、急需破解的问题,作为研发的一个导向。
中国科学院深圳先进技术研究院医工所副所长 李烨:以前的科研合作一般就是科研单位做了原理的验证,然后就交给企业,企业再去变成产品。那我们这个从最开始的包括立项、提出问题、提出技术路线,到最后的实现,到变成产品的全链条,我们都有深度参与。
随着合作的深入,企业带来的市场反馈,也让研发机构有了新的突破。第一批国产核磁共振仪器,合作开发单位之一就是联影医疗,仪器上市不久,他们就为科研团队带来了临床反馈。
联影医疗科技股份有限公司董事长 张强:联影提出了针对临床上出现的问题、我们市场上碰到的挑战,把这些问题总结出来,深圳先进技术研究院利用他们比较雄厚的研发实力来一起攻关。
市场的痛点,成了研发单位首要的攻克目标,最新一代的国产核磁共振仪器,已经完全达到了医院提出的图像质量要求。
中国科学院深圳先进技术研究院副院长 郑海荣:团队的核心就是要围绕这些痛点里的技术进行攻关,解决了这一揽子的快速成像的软件和硬件、电子学,形成了100多个发明专利。这样转化效率就非常高,是精准地提炼问题、攻关。
郑海荣告诉记者,这些年,中国科学院深圳先进技术研究院在研发机构和产业融合方面探索的案例还有很多。
这座楼叫作“工程生物产业创新中心”,这是一个“楼上楼下”的创新综合体,楼上是研究院,楼下是企业,楼上的“科学家”随时可以下楼找到“企业家”,一起商量产品转化。而这个国家高性能医疗器械创新中心,成立刚刚三年,就已经促成多家医疗机构和研发单位融合,实现10多个重大科研成果的产业转化。
政府+市场
助推科研成果转化 …
科创板“标准五”将从严,械企上市更难了?
近日,多家媒体报道提及,科创板第五套上市标准或将趋于收紧,监管将对采用第五套上市标准递交材料申报的企业,进行更加严格的审核。
根据《上海证券交易所科创板股票上市规则》第2.1.2条规定,科创板第五套上市标准为“(五)预计市值不低于人民币40亿元,主要业务或产品需经国家有关部门批准,市场空间大,目前已取得阶段性成果。医药行业企业需至少有一项核心产品获准开展二期临床试验,其他符合科创板定位的企业需具备明显的技术优势并满足相应条件。”
采用科创板第五套上市标准的企业概况
2022年6月10日,上交所发布并实施《上海证券交易所科创板发行上市审核规则适用指引第7号——医疗器械企业适用第五套上市标准》,支持尚未形成一定收入规模的“硬科技”医疗器械企业在科创板发行上市,有望为更多国产医疗器械企业带来资本助力。
截至2023年4月30日,共有42家企业采用第五套标准申请科创板上市,其中已发行上市19家,注册生效2家,7家已主动撤回、终止审核,14家处于审核问询阶段。
图1:采用第五套标准申请上市企业的审核受理情况
(按审核阶段统计)
资料来源:康橙投资、iFind
2020年和2022年采用第五套标准成功上市的企业较多,分别达到了7家和8家。其中值得我们关注的是,从2022年第四季度以来,已经接近有3个季度未有采用第五套标准成功上市的企业。
图2:采用第五套标准成功上市的情况(按季度统计)
资料来源:康橙投资、iFind
在采用第五套标准申请上市的企业中,已有19家企业成功上市。其中最新一家是2022年8月31日上市的微电生理,并且是目前唯一一家成功上市的医疗器械类公司。
在42家采用第五套标准申请上市的企业中,除已上市的19家企业,共有23家在审核或终止上市的企业。
图3来源:康橙投资、iFind
科创板开板后,医疗器械企业在科创板上市的家数逐年提高,国内医疗器械企业呈现出回归A股上市的趋势。科创板医疗器械行业无论是从上市企业数量,还是从平均首发市盈率来看,都明显高于其他板块。未来随着依据科创板第五套标准上市企业的增多,预计科创板也将出现较多尚未形成一定收入规模的、处于亏损状态的医疗器械企业。
目前拟上市的医械企业
捍宇医疗
上海捍宇医疗科技股份有限公司(“捍宇医疗”)申请上市3月1日获科创板受理,拟融资17.22亿元。
捍宇医疗主要从事结构性心脏病介入器械与电生理产品的研发、生产及商业化。在结构性心脏病介入器械领域,公司ValveClamp产品为国内率先纳入创新医疗器械特别审批程序的二尖瓣反流介入治疗器械,并有望成为首款获批上市的国产同类产品,打破目前中国二尖瓣反流介入治疗领域国产空白的市场格局,推动国产医疗器械的持续创新及进口替代。
思哲睿
国家药监局暂停进口、经营和使用韩国韩士生科公司同种异体骨修复材料
多地骨科脊柱类耗材集采中选结果落地
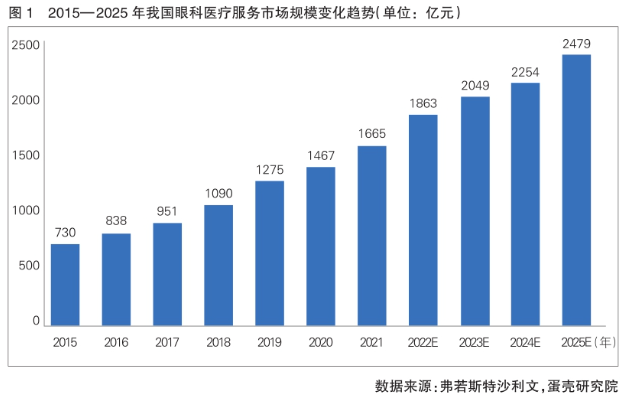
眼科医疗设备需求持续释放国产替代空间广阔
国家药监局通报6起医疗器械网络销售违法违规案件信息
国家药监局指导各级药品监督管理部门加强医疗器械网络销售监管,依托国家医疗器械网络销售监测平台,加强医疗器械网络销售监测和违法违规线索处置,严厉打击违法违规行为。各级药品监管部门积极行动,查处了一批违法违规案件,切实维护人民群众身体健康和用械安全。现通报6起医疗器械网络销售违法违规案件信息。
一、漯河市德家医疗器械有限公司未经许可在阿里巴巴网销售第三类医疗器械
2022年3月24日,漯河市市场监督管理局经济技术开发区分局根据国家医疗器械网络销售监测平台提供线索,对漯河市德家医疗器械有限公司进行检查。经查,当事人未取得医疗器械经营许可证在阿里巴巴网销售第三类医疗器械“人类免疫缺陷病毒p24抗原及抗体检测试剂盒(胶体硒法)”,上述行为违反了《医疗器械监督管理条例》第四十二条、第四十六条规定。依据《医疗器械监督管理条例》第八十一条规定,漯河市市场监督管理局经济技术开发区分局给予当事人行政处罚。
二、芜湖瞳妹电子商务有限责任公司在拼多多商城销售医疗器械,擅自变更经营方式、未建立进货查验记录和销售记录制度、未按照要求展示医疗器械注册证
2022年11月8日,芜湖市市场监督管理局根据国家医疗器械网络销售监测平台提供线索,对芜湖瞳妹电子商务有限责任公司进行检查。经查,当事人入驻拼多多商城销售“软性亲水接触镜”,存在无法提供相关产品的进货查验材料及销售记录,未在产品页面展示产品医疗器械注册证,擅自增加零售经营方式等行为。上述行为分别违反了《医疗器械监督管理条例》第四十五条、《医疗器械网络销售监督管理办法》第十条和《医疗器械经营监督管理办法》第十五条规定。依据《医疗器械监督管理条例》第八十九条、《医疗器械网络销售监督管理办法》第四十条和《医疗器械经营监督管理办法》第六十六条规定,芜湖市市场监督管理局给予当事人行政处罚。
三、河北嘉越医疗器械商贸有限公司在拼多多商城销售医疗器械,擅自变更经营方式
2022年12月30日,衡水市市场监督管理局根据国家医疗器械网络销售监测平台提供线索,对河北嘉越医疗器械商贸有限公司进行检查。经查,当事人擅自增加零售经营方式,在拼多多商城向消费者个人销售“甲型/乙型流感病毒抗原检测试剂(胶体金法)”。上述行为违反了《医疗器械经营监督管理办法》第十五条规定。依据《医疗器械经营监督管理办法》第六十六条规定,衡水市市场监督管理局给予当事人行政处罚。
四、深圳市千誉科技有限公司在京东商城销售医疗器械,未展示医疗器械经营备案凭证和医疗器械注册证,且未按要求整改
2022年11月8日,深圳市市场监督管理局南山监管局根据国家医疗器械网络销售监测平台提供线索,对深圳市千誉科技有限公司进行检查。经查,当事人在京东商城销售“强脉冲光治疗仪”未展示医疗器械经营备案凭证和医疗器械注册证,被警告后逾期仍不整改,上述行为违反了《医疗器械网络销售监督管理办法》第十条规定。依据《医疗器械网络销售监督管理办法》第四十条规定,深圳市市场监督管理局南山监管局给予当事人行政处罚。
五、春妙(上海)医疗器械有限公司在找商网销售医疗器械,未展示医疗器械注册证,且未按要求整改
2022年9月30日,上海市静安区市场监督管理局根据国家医疗器械网络销售监测平台提供线索,对春妙(上海)医疗器械有限公司进行检查。经查,当事人在找商网销售“医用一次性防护服”,未展示该产品医疗器械注册证,当事人曾因未展示医疗器械注册证被责令改正和警告,上述行为违反了《医疗器械网络销售监督管理办法》第十条规定。依据《医疗器械网络销售监督管理办法》第四十条规定,上海市静安区市场监督管理局给予当事人行政处罚。
六、厦门走启医疗科技有限公司在京东商城销售医疗器械,未按照要求展示医疗器械经营备案凭证和医疗器械注册证
2023年1月17日,厦门市湖里区市场监督管理局根据国家医疗器械网络销售监测平台提供线索,对厦门走启医疗科技有限公司进行检查。经查,该公司于2022年11月变更企业名称,在入驻京东商城的店铺“锁蝶医疗器械专营店”展示的第二类医疗器械经营备案凭证未及时更新,其销售的“高频电灼治疗仪”的详情页未展示产品医疗器械注册证、未以文本形式展示医疗器械注册证编号,上述行为违反了《医疗器械网络销售监督管理办法》第十条规定。依据《医疗器械网络销售监督管理办法》第四十条规定,厦门市湖里区市场监督管理局给予当事人行政处罚。
医疗器械网络销售安全提示:医疗器械网络交易服务第三方平台企业要以对公众健康高度负责的精神,认真贯彻《医疗器械监督管理条例》《医疗器械网络销售监督管理办法》等规定,严格履行主体责任,持续加强合规建设,严格审查入网医疗器械经营者及其经营医疗器械产品合法资质,严格管理入网经营者医疗器械经营行为,对平台内经营者的违法违规行为,及时制止并报告药品监管部门。医疗器械经营企业应严格按照相关法律法规要求开展医疗器械网售业务。
广大消费者在网购医疗器械时,请从具备相关经营资质的医疗器械经营企业购买,并查看所购产品是否取得医疗器械注册证,切勿贪图价格便宜从非正规网店或商家购买未经注册的产品。消费者如发现无相关经营资质网售医疗器械等违法违规行为,请及时进行投诉举报。投诉举报热线:12315。
药品监管部门将进一步认真贯彻落实“四个最严”要求,突出问题导向,坚持综合施策,完善法规制度,创新监管方式,严厉打击违法违规行为,规范医疗器械网络销售市场秩序。
来源:国家药监局网站…
国家医保局:开展新批次国家组织高值医用耗材集采
美敦力最新年报出炉
心血管产品组合:收入为 114.23 亿美元,增长 6%
医疗外科产品组合:收入为 91.41 亿美元,增长 5%
神经科学产品组合:收入为 87.84 亿美元,增长 7%
糖尿病:收入为 23.38 亿美元,下降 3%

