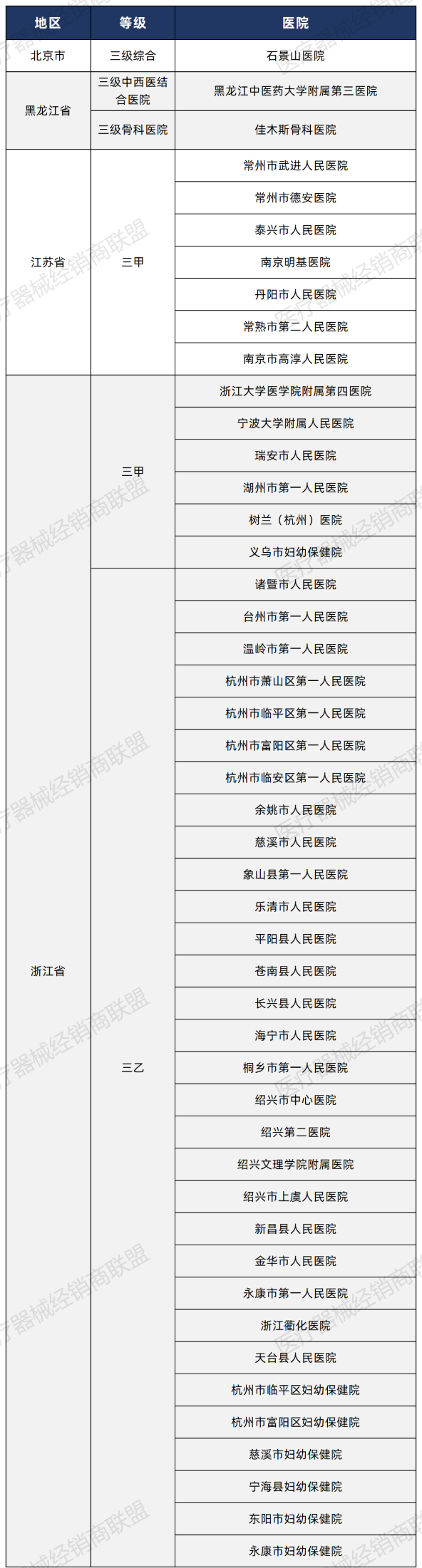
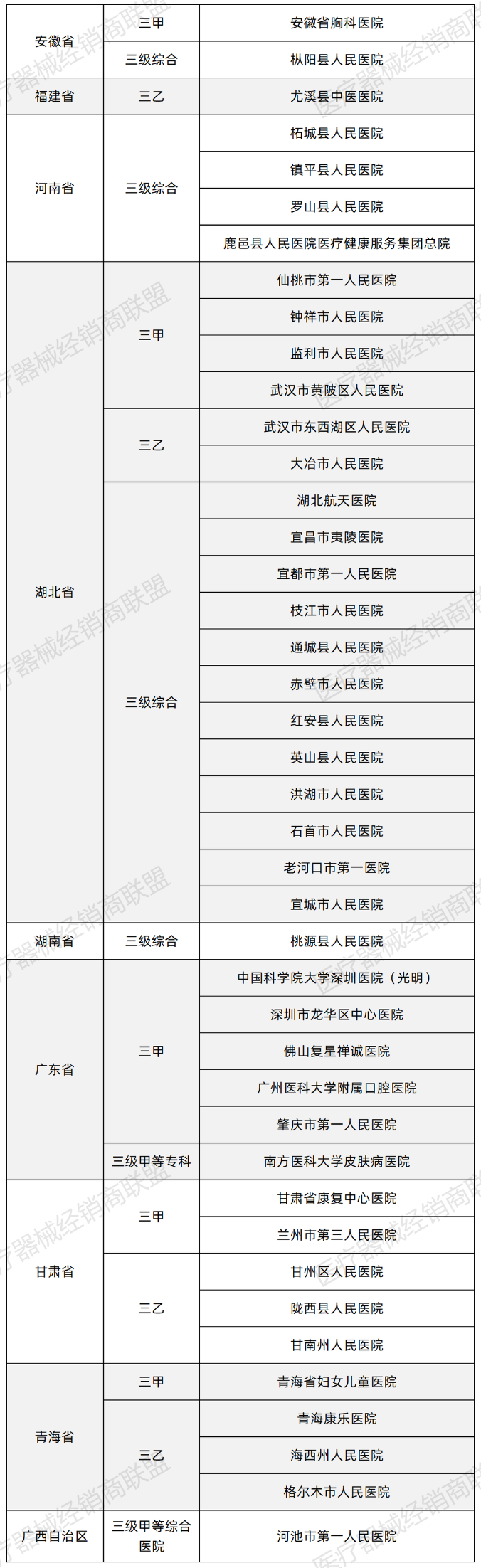
心腔内超声(ICE)是一种新兴超声心动图诊断技术,通过血管途径将装有微型超声换能器探头的导管置于心腔内部,发射并接收高频超声信号,实现对心脏解剖结构的实时成像。目前,ICE已被应用于房颤射频消融术、左心耳封堵术、房间隔缺损封堵术、二尖瓣成形术、心内膜心肌活检术等多种结构性心脏病手术中。
临床研究结果表明,ICE的应用能够有效提高房颤射频消融术、左心耳封堵术等手术的精准度、安全性和效率,降低手术风险,减少术后并发症,缩减手术成本,同时提高患者的舒适度。基于显著的临床优势,ICE市场需求空间十分广阔,全球众多企业正积极布局ICE相关产品管线。
技术迭代升级
早在20世纪50年代就有研究人员开始探索运用导管与超声技术对心脏结构进行成像。不过,受技术水平的限制,当时的探索并未成功。直到20世纪80年代,伴随超声成像技术与导管介入技术的发展,ICE得以应用。不过,在应用之初,ICE系统的换能器频率较高(20~40MHz),组织穿透能力有限,无法用于获得心内解剖图。
此后,有研究人员开发出低频(9MHz)换能器,使ICE系统可对心内结构进行成像,但这些系统仍存在导管灵活度低、成像深度低、不能用于观察完整的心脏结构等不足。对此,有研发厂商开发了具有更低频率(5MHz)的换能器,以优化ICE系统的成像深度,但换能器尺寸较大,限制了相应产品的临床应用。
超声相控阵技术在ICE领域的应用,不仅解决了换能器尺寸较大的问题,还推动ICE系统的临床应用范围进一步扩大。具体而言,相控阵ICE的成像深度更大,图像更加清晰,还可提供多种影像学信息。
超声换能器逐渐向微型化的方向发展,推动旋转式ICE广泛应用于临床。旋转式ICE与相控阵ICE各具优势:旋转式ICE在应用时可提供更高的近场分辨率;相控阵ICE在应用时可提供心脏解剖结构、彩色血流信号、频谱多普勒图像等多种信息。目前,相控阵ICE的应用更为广泛。
21世纪初,西门子医疗推出了全球第一支二维ICE导管ACUSON AcuNav。该产品最初主要用于指导房间隔穿刺术,后续开始应用于房间隔缺损封堵术、左心耳封堵术等多种结构性心脏病手术。二维ICE支持双平面或三平面成像,可显示两个或三个不同的平面视图,但医生需要将这些图像在脑海中重新构建为三维解剖结构。
随着ICE的广泛应用,其性能不断优化,逐步从二维成像发展为三维成像,极大增强了引导及可视化能力。三维ICE在应用时可直接呈现三维解剖结构图,便于医生更轻松地开展手术。
近几年来,西门子、强生等企业创新推出了实时三维ICE系统。相较于二维ICE,实时三维ICE不仅能够实时成像,还可以用于显示心脏三维结构及血流等信息,且呈现的影像更加清晰、精准。
从产品发展方向来看,预计将有越来越多的ICE系统从二维发展为三维,甚至从三维发展为实时三维和四维,向成像更加清晰、精准以及多功能等方向发展。
临床优势明显
此前,临床上已有经食管超声技术(TEE)和经胸超声技术(TTE)的相关应用。相较于TEE,ICE的操作更加灵活,并能够从心脏内部成像,有助于更加精确地排查血栓、指导手术。另外,在采用TEE开展手术时,需要对某些特殊人群采取全身麻醉;而使用ICE时仅需要局部麻醉,且避免了食管插管操作带给患者的不适体验,以及TEE探头对食管壁黏膜的机械性损伤和扫描时可能引起的热损伤。相较于TTE,ICE的应用不受患者肥胖、肺气肿、胸廓畸形等因素的影响,可实现更短距离、更高精度成像。
同时,相较于TEE、TTE等传统方式,ICE可实时监测术中血栓及心包积液等潜在并发症发生的手术风险,从而有效提高手术的安全性;同时,ICE可由手术医生独立操作,不依赖于超声科及麻醉科医师,手术安排更灵活,同时降低手术的人员成本,提高手术效率,减少手术各环节耗时。
在临床上,TEE检查结果一直是在开展房颤导管消融术或左心耳封堵术之前排查左心房及左心耳血栓的金
…